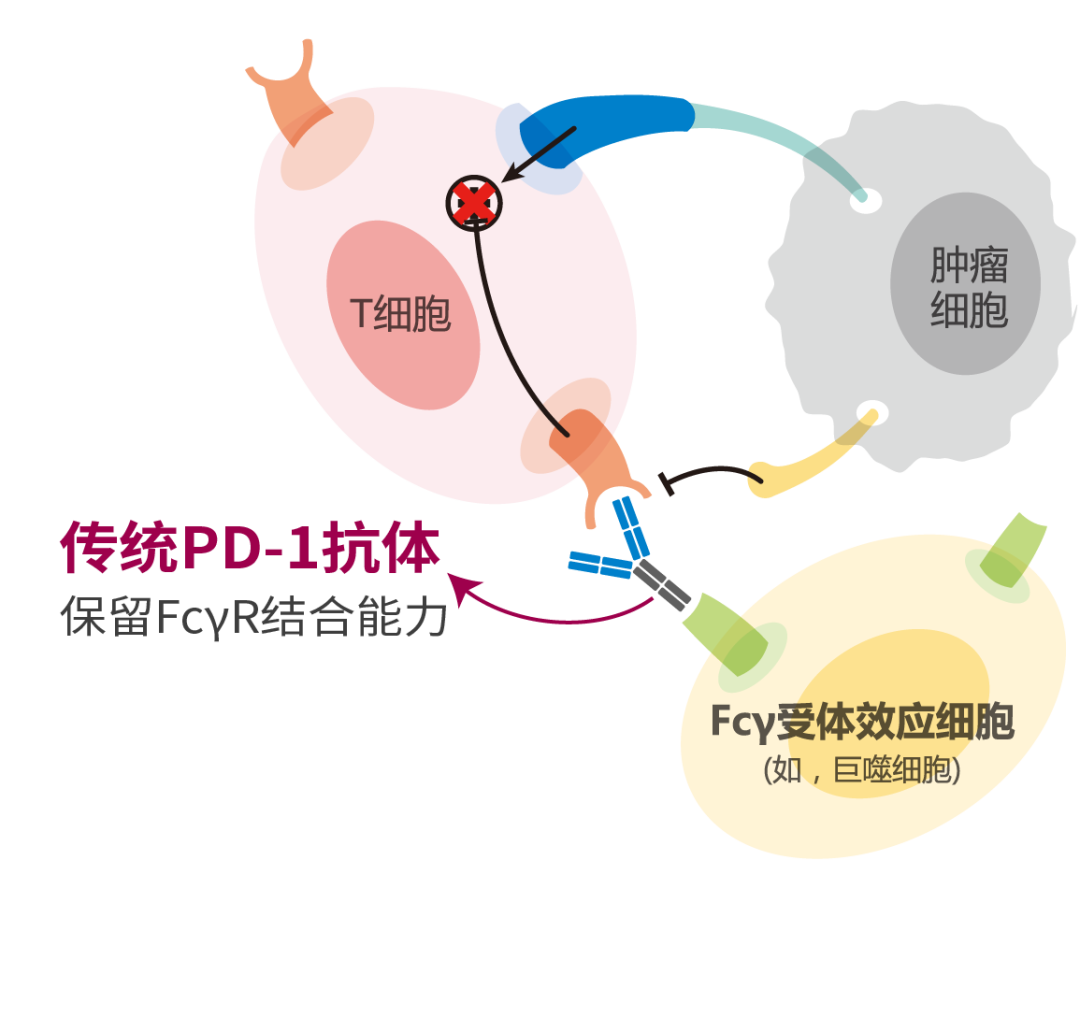
肺癌是目前全球发病率第二、死亡率最高的恶性肿瘤,其中非小细胞肺癌(NSCLC)最为常见,约占肺癌总发病率的85%。随着免疫治疗的快速发展,多种免疫联合方案已逐渐成熟,为更多晚期NSCLC患者带来了更好的生存获益。伴随免疫治疗药物临床研究的深入开展,我国自主研发的免疫治疗药物亦大放异彩。本期昆明医科大学第一附属医院赵培珠教授和郭希婧教授为您分享一例EGFR p.G779F突变伴PD-L1阳性晚期肺鳞癌病例,替雷利珠单抗联合化疗为该患者带来了持久获益。 病例分享 赵培珠 教授
郭希婧 教授
病例详情
基本情况
一般情况:患者,男,45 岁。
病史:
(1)现病史:2020年3月上旬始无明显诱因出现阵发性咳嗽,咳少量黏液痰,痰中带血丝,伴左耳后区及胸背部疼痛,疼痛渐进性加剧,自服“止痛药”后症状无缓解,2020年4月17日收住院。
(2)家族史:无家族遗传性疾病史。
(3)个人史:吸烟20年,平均20支/日。
(4)入院查体:ECOG评分:1分,未吸氧状态下SPO2:93%,全身浅表淋巴结未触及肿大,气管居中,胸廓对称,双肺叩诊清音,左肺上叶呼吸音明显增粗,未闻及干湿性啰音,胸椎第7-11椎体叩痛明显。
(5)影像学检查:
入院后2020年4月18日胸部CT示:左肺上叶近肺门软组织肿块(最大层面范围约6.1cmx2.7cm),中央型肺癌可能,并左肺上叶阻塞性肺炎;双肺多发结节,转移灶待排;纵隔内及左侧肺门区见多发肿大淋巴结,转移灶可能(图1)。腹部CT示:右侧肾上腺区见软组织肿块影,大小约4.7cmx2.5cm,左侧肾上腺区见结节状软组织密度影,大小约1.7cmx1.4cm,增强均呈轻度不均匀强化(图2)。2020年4月24日头颅MR平扫+增强+弥散示:颅内未见占位,左侧颈静脉孔后下缘约3.1cmx1.5cm大小片状不均匀边缘强化病灶,转移灶可能(图3)。胸椎MR平扫+增强示:胸7椎体水平右侧椎弓、肋骨及软组织明显不规则强化改变,胸10-11椎体水平右侧椎旁肋椎关节及周围软组织水肿及强化改变,转移灶可能(图4)。

图1 CT平扫+增强:左肺上叶占位并左肺上叶阻塞性肺炎,纵隔内及左侧肺门区多发肿大淋巴结

图2 CT平扫+增强:双侧肾上腺区占位

图3 MR平扫+增强+弥散:左侧颈静脉孔后下缘约3.1cm x 1.5cm大小片状不均匀边缘强化病灶

图4 MR平扫+增强:T7椎体水平右侧椎弓、肋骨及软组织明显不规则强化改变
02临床诊断
病理诊断:2020年4月20日(左主支气管新生物活检):倾向低分化鳞状细胞癌。
免疫组化:P40(+),P63(+),CK5/6(+),Ki-67%(+60%),CK广(+),Syn(-),CgA(-),CK7(+),TTF-1(-),Napsin-A(-),CD56(-),ALK(±),EGFR(+),PD-L1(-)。
临床分期:左肺上叶低分化鳞状细胞癌 T3N2M1c IVB期。
分子检测诊断结果及分析:

图5 NGS检测结果
(1)患者肿瘤组织及血浆中均有高丰度的EGFR p.G779F突变。p.G779F为EGFR第20外显子错义突变,位于7号染色体短臂1区1带2号亚带上(7p11.2),属EGFR罕见突变,其突变率为0.01%,其中肺腺癌的患病率最高[1],在该患者确诊时尚未见有EGFR p.G779F突变的临床治疗报道。
(2)EGFR扩增:EGFR扩增患者更有可能伴随着多通路激活。相较于无EGFR扩增的患者,有EGFR扩增者出现其他基因突变的比例明显增高,EGFR扩增是EGFR-TKI靶向治疗的潜在耐药机制[2]。
(3)TP53/ target=_blank class=infotextkey>P53第8外显子突变:导致P53正常抑癌功能失活,促进肿瘤细胞增殖、迁移与抗凋亡等进程,参与肿瘤的发生发展;并可能引起铂类、氟尿嘧啶类等化疗药物的耐药[3];TP53突变与PD-L1表达的上调和T效应激活有关[4]。
PD-L1 免疫组化检测结果及分析:

图6 PD-L1免疫组化检测报告:PD-L1高表达,TPS≥10%(TPS=90%)
PD-L1呈高表达,TPS≥10%(TPS=90%)。PD-L1 TPS 表达水平与PD-1/PD-L1抑制剂疗效总体上呈正相关。对于TPS≥50%患者,部分PD-1/PD-L1抑制剂联合或单药治疗较化疗显著延长晚期肺鳞癌患者的PFS及OS[5, 6]。
03诊疗经过
2020年5月8日始行替雷利珠单抗+紫杉醇+卡铂方案治疗,每21天1周期。期间,予同步行左颈静脉孔区转移灶放射治疗66Gy/33F、胸椎骨转移椎体及椎旁转移灶放射治疗40Gy/20F。
2020年6月23日第2周期免疫联合化疗后复查示肿瘤较前明显消退,达PR(图7),患者症状明显改善,继续免疫联合化疗4个周期,复查肿瘤病灶持续缩小,之后行替雷利珠单抗单药免疫维持治疗,每21天1周期。

图7 胸部CT平扫+增强(2020年6月23日,2周期免疫联合化疗后胸部病灶达PR)
2022年2月复查无进展,至2022年6月替雷利珠单抗免疫治疗满两年,改为替雷利珠单抗每42天1周期维持至今。
2022年9月复查肿瘤无进展(图8、图9、图10、图11)。患者免疫维持治疗至今,无明显治疗副反应。
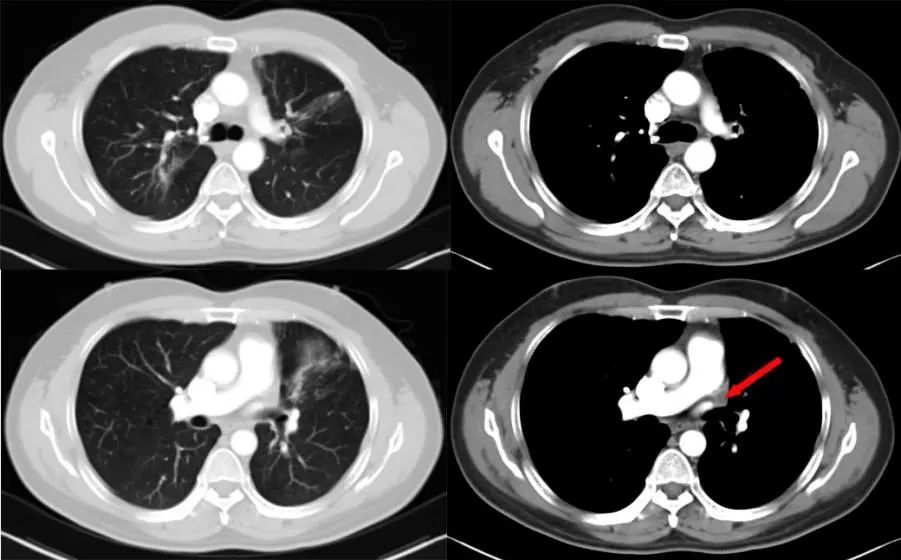
图8 胸部CT平扫+增强(2022年9月7日,治疗后第28个月,胸部病灶达PR)

图9 腹部CT平扫+增强(2022年9月7日,治疗后第28个月,双侧肾上腺转移灶达PR)
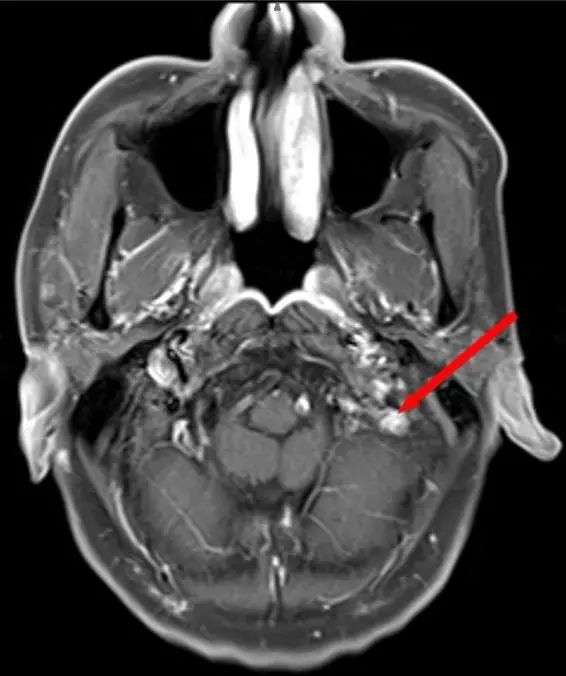
图10 头颅MR平扫+增强(2022年9月10日,治疗后第28个月,左颈静脉孔区病灶达PR)

图11 胸椎MR平扫+增强(第7胸椎平面)(2022年9月10日,治疗后第28个月,胸椎、肋骨及椎旁软组织转移灶达PR)
疗效评价:目前规律复查,至撰写本文时已持续27个月疾病呈PR状态,ECOG评分:0分。
病例总结
如上资料所示,本例患者为IVB期肺鳞癌,NGS显示肿瘤组织及血浆中均有高丰度的EGFR p.G779F突变,该突变极为罕见,在本例患者初始治疗时,我们查阅了文献,未见有该突变的治疗报道,其对TKI的疗效不明。同时该患者尚有EGFR扩增、TP53突变等共存,是TKI治疗的不利因素。而肺鳞癌EGFR突变率显著低于肺腺癌,相较于EGFR突变的肺腺癌患者,接受TKI治疗的EGFR突变肺鳞癌患者PFS和OS更短[7]。
从现有的研究结果来看,免疫治疗在EGFR突变患者中的效果不如野生型EGFR患者,NCCN指南、CSCO指南并不支持驱动基因阳性的晚期NSCLC患者一线使用免疫治疗。事实上,在携带罕见EGFR突变的晚期NSCLC患者中观察到有较高比例的PD-L1表达(36.7%)和CD8+TILs浸润,并显示出对PD-1抑制剂初始治疗的敏感性[8]。本例患者尚有TP53突变,有研究显示免疫检查点抑制剂用于TP53合并其他基因共突变的NSCLC患者,共突变患者较野生型患者有更长的PFS(9.2个月和4.2个月,P=0.01)[9]。
替雷利珠单抗为一款我国自主研发的PD-1抑制剂,其出色的疗效数据与独特的药学结构密不可分。RATIONALE 307研究[10]结果表明,替雷利珠单抗联合化疗一线治疗局部晚期或转移性鳞状NSCLC患者,疾病进展风险降低52%,中位PFS延长至7.6个月,且ORR高达75%,开创了中国肺鳞癌一线治疗新标准。基于RATIONALE 307研究和RATIONALE 304研究[11]结果,替雷利珠单抗已先后获批晚期鳞状、非鳞状NSCLC一线治疗适应症,且成功纳入国家医保药品目录,提高了临床可及性。此外,RATIONALE 303研究[12]证实了替雷利珠单抗单药在局部晚期或转移性NSCLC患者二/三线治疗中的有效性,中位OS长达17.2个月,较对照组延长近半年,创造了晚期NSCLC二/三线治疗新高度。基于以上研究,替雷利珠单抗成为全球首个晚期NSCLC全线全人群获益、适应症全覆盖的PD-1/L1单抗。
在无驱动基因晚期NSCLC患者中,TPS≥50%患者可进行免疫检查点抑制剂联合或单药治疗。虽然本例患者PD-L1 高表达(TPS=90%),但鉴于患者肿瘤负荷重,有TKI疗效不明的高丰度EGFR罕见突变等因素,经过讨论,我们采用了免疫联合化疗(替雷利珠单抗+紫杉醇+卡铂),同时进行局部放射治疗(放射治疗既能增强PD-1抑制剂疗效[13, 14],又可迅速缓解本例患者骨转移所致的剧烈疼痛),之后再进行免疫维持治疗,这一策略获得了令人满意的临床疗效。本例患者通过个体化治疗目前已获得27个月的持续缓解,且无明显治疗副反应,而本例患者超过两年的免疫治疗,也进一步印证了替雷利珠单抗卓越的疗效及安全性,有望助力患者实现高质量的更长生存。
从免疫治疗大放异彩至今,两年治疗后是否继续维持仍无定论。继续每三周一次维持治疗?但无安全性数据;停药随访?然患者疗前肿瘤负荷重,又恐生变。鉴于替雷利珠单抗与PD-1的结合持久、解离速率慢等特点,笔者在反复斟酌后,折中方案,尝试每六周一次的维持治疗,并密切随访。
参考文献:
[1] AACR Project GENIE Consortium. AACR Project GENIE: Powering Precision Medicine through an International Consortium[J]. Cancer Discov, 2017,7(8):818-831. DOI: 10.1158/2159-8290.CD-17-0151.
[2] Kato S, Okamura R, Mareboina M, et al. Revisiting Epidermal Growth Factor Receptor (EGFR) Amplification as a Target for Anti-EGFR Therapy: Analysis of Cell-Free Circulating Tumor DNA in Patients With Advanced Malignancies[J]. JCO Precis Oncol, 2019,3DOI: 10.1200/PO.18.00180.
[3] Liu Y, Chen C, Xu Z, et al. Deletions linked to TP53 loss drive cancer through p53-independent mechanisms[J]. Nature, 2016,531(7595):471-475. DOI: 10.1038/nature17157.
[4] Cortez MA, Ivan C, Valdecanas D, et al. PDL1 Regulation by p53 via miR-34[J]. J Natl Cancer Inst, 2016,108(1):303. DOI: 10.1093/jnci/djv303.
[5] Herbst RS, Giaccone G, de Marinis F, et al. atezolizumab for First-Line Treatment of PD-L1-Selected Patients with NSCLC[J]. N Engl J Med, 2020,383(14):1328-1339. DOI: 10.1056/NEJMoa1917346.
[6] wu Y, Zhang L, Fan Y, et al. MA11.02 KEYNOTE-042 China Study: First-Line pembrolizumab vs Chemotherapy in Chinese Patients with Advanced NSCLC with PD-L1 TPS ≥1%[J]. J Thorac Oncol, 2019,14(10):290. DOI: 10.1016/j.jtho.2019.08.584.
[7] Rekowska A, Rola P, Wójcik-Superczyńska M, et al. Efficacy of Osimertinib in Lung Squamous Cell Carcinoma Patients with EGFR Gene Mutation-Case Report and a Literature Review[J]. Curr Oncol, 2022,29(5):3531-3539. DOI: 10.3390/curroncol29050285.
[8] Chen K, Cheng G, Zhang F, et al. PD-L1 expression and T cells infiltration in patients with uncommon EGFR-mutant non-small cell lung cancer and the response to immunotherapy[J]. Lung Cancer, 2020,142:98-105. DOI: 10.1016/j.lungcan.2020.02.010.
[9] Wang S, Jiang M, Yang Z, et al. The role of distinct co-mutation patterns with TP53 mutation in immunotherapy for NSCLC[J]. Genes Dis, 2022,9(1):245-251. DOI: 10.1016/j.gendis.2020.04.001.
[10] Wang J, Yu X, Lu S, et al. Phase III study of Tislelizumab plus chemotherapy vs chemotherapy alone as first-line (1L) treatment for advanced squamous non-small cell lung cancer (sq NSCLC) [J]. J Clin Oncol, 2020,38(15_suppl):9554. DOI: 10.1200/JCO.2020.38.15_suppl.9554.
[11] Lu S, Wang J, Yu Y, et al. Tislelizumab Plus Chemotherapy as First-Line Treatment for Locally Advanced or Metastatic Nonsquamous NSCLC (RATIONALE 304): A Randomized Phase 3 Trial. J Thorac Oncol. 2021 Sep;16(9):1512-1522. doi: 10.1016/j.jtho.2021.05.005. Epub 2021 May 23. PMID: 34033975.
[12] Zhou C, Huang D, Fan Y, et al. Tislelizumab versus docetaxel in patients with previously treated advanced non-small cell lung cancer (RATIONALE-303): a phase 3, open-label, randomized controlled trial. J Thorac Oncol. 2022 Sep 29:S1556-0864(22)01803-2. doi: 10.1016/j.jtho.2022.09.217. Epub ahead of print. PMID: 36184068.
[13] Shaverdian N, Lisberg AE, Bornazyan K, et al. Previous radiotherapy and the clinical activity and toxicity of pembrolizumab in the treatment of non-small-cell lung cancer: a secondary analysis of the KEYNOTE-001 phase 1 trial[J]. Lancet Oncol, 2017,18(7):895-903. DOI: 10.1016/S1470-2045(17)30380-7.
[14] Metro G, Addeo A, Signorelli D, et al. Outcomes from salvage chemotherapy or pembrolizumab beyond progression with or without local ablative therapies for advanced non-small cell lung cancers with PD-L1 ≥50% who progress on first-line immunotherapy: real-world data from a European cohort[J]. J Thorac Dis, 2019,11(12):4972-4981. DOI: 10.21037/jtd.2019.12.23.
[15] S.Novello, et al. 5-year update from KEYNOTE-407: Pembrolizumab plus chemotherapy in squamous non-small cell lung cancer (NSCLC); September 9-13, 2022; Paris, France; 974MO.
[16] Wang Y, Yang X, Tian X, et al. Neoadjuvant immunotherapy plus chemotherapy achieved pathologic complete response in stage IIIB lung adenocarcinoma harbored EGFR G779F: a case report[J]. Ann Palliat Med, 2020,9(6):4339-4345. DOI: 10.21037/apm-20-1692.
[17] Li H, Dong S, Zhang D, et al. Targeted Sequencing Facilitated Diagnosis of an Uncommon Patient Harboring Both Multiple Primary and Intrapulmonary Metastatic Lung Cancer: A Case Report[J]. Onco Targets Ther, 2021,14:3455-3459. DOI: 10.2147/OTT.S309155.